Această revizuire subiectivă a literaturii ar putea fi parțial incompletă sau incorectă.
Aceasta este o traducere / adaptare a unui articol original regăsit pe site-ul Dysautonomia Support Network
Cuvânt înainte, despre legătura cu autismul și ADHD-ul
În ultimii ani, cercetătorii au observat o legătură din ce în ce mai evidentă între diferitele forme de disautonomie și tulburările de neurodezvoltare, în special autismul și ADHD-ul. Această conexiune intrigantă a deschis noi perspective în înțelegerea modului în care sistemul nervos autonom poate influența nu doar funcțiile fiziologice, ci și procesele cognitive și comportamentale:
- Studiile au arătat că persoanele autiste prezintă adesea simptome asociate cu disfuncția sistemului nervos autonom, cum ar fi:
- probleme de reglare a temperaturii corporale;
- tulburări gastrointestinale;
- anxietate crescută.
- În mod similar, persoanele cu ADHD raportează frecvent:
- amețeli;
- palpitații;
- intoleranță la efort fizic.
Acestea sunt trăsături caracteristice anumitor forme de disautonomie, în special sindromului de tahicardie posturală ortostatică (POTS).
Aceste observații au condus la ipoteza că ar putea exista mecanisme neurobiologice comune care stau la baza atât a disautonomiei, cât și a tulburărilor neurodezvoltare. De exemplu, dezechilibrele în sistemul nervos autonom ar putea contribui la dificultățile de procesare senzorială și reglare emoțională observate în autism, sau la problemele de atenție și hiperactivitate caracteristice ADHD-ului.
Mai mult, s-a observat că tratamentele care vizează ameliorarea simptomelor disautonomiei pot avea uneori efecte pozitive și asupra simptomelor asociate ADHD-ului sau dificultăților asociate autismului. Acest lucru sugerează că abordarea disfuncției autonome ar putea fi o strategie terapeutică complementară în managementul acestor tulburări de neurodezvoltare.
Este important de menționat că relația dintre disautonomie, autism și ADHD este complexă și multifactorială. Așadar:
- NU toate persoanele autiste sau cu ADHD vor experimenta disautonomie
- NU toți pacienții cu disautonomie nu vor prezenta trăsături autiste și/sau ADHD.
Cu toate acestea, recunoașterea acestei posibile conexiuni poate conduce la o abordare mai holistică și personalizată în diagnosticarea și tratarea pacienților.
În contextul acestor descoperiri, prezentul articol despre formele de disautonomie capătă o relevanță și mai mare. Înțelegerea detaliată a simptomelor, criteriilor de diagnostic și opțiunilor de tratament pentru diferitele forme de disautonomie poate fi esențială nu doar pentru pacienții care se confruntă direct cu aceste afecțiuni, ci și pentru cei care gestionează tulburări de neurodezvoltare și au în evidență pacienți cu simptome autonome asociate.
Pe măsură ce cercetarea în acest domeniu avansează, este probabil să descoperim noi conexiuni și să dezvoltăm strategii de tratament mai eficiente care să abordeze atât disautonomia, cât și manifestările neuropsihiatrice asociate. Acest lucru subliniază importanța unei abordări interdisciplinare în cercetare și practica clinică, care să îmbine cunoștințe din neurologie, cardiologie, psihiatrie și alte specialități relevante.
Așadar, pe măsură ce citiți acest articol despre formele de disautonomie, vă încurajăm să reflectați asupra posibilelor implicații majore ale acestor afecțiuni, dincolo de simptomele lor imediate și evidente.
Tensiunea Posturală Ortosatică / Postural Orthostatic Tachycardia Syndrome (POTS)
Criterii de diagnostic (²) (³)
- O creștere susținută a frecvenței cardiace de cel puțin 30 de bătăi pe minut (bpm) la adulți și de 40 de bătăi pe minut (bpm) la persoanele cu vârsta cuprinsă între 12 și 19 ani, în decurs de 10 minute de la statul în picioare.
- Absența hipotensiunii ortostatice (nicio scădere a tensiunii arteriale mai mare de 20/10 milimetri coloană de mercur - mmHg). Simptomele intoleranței ortostatice (amețeli, palpitații, tremurături, disconfort toracic) au fost prezente timp de cel puțin 3 luni.
- Au fost excluse alte afecțiuni care determină creșterea frecvenței cardiace (de exemplu, atacuri de panică, durere, exerciții fizice, cafeină, alcool, medicamente, anemie, tahicardie sinusală inadecvată, hipertiroidism și deshidratare).
Ghidurile actuale afirmă că, în general, o persoană nu poate avea hipotensiune ortostatică și POTS (⁴) (⁵).
În cele din urmă, persoanele cu POTS pot leșina, dar acesta nu este un simptom-cheie. De fapt, doar aproximativ 30% dintre cei cu POTS suferă de sincopă (⁶) (⁷).
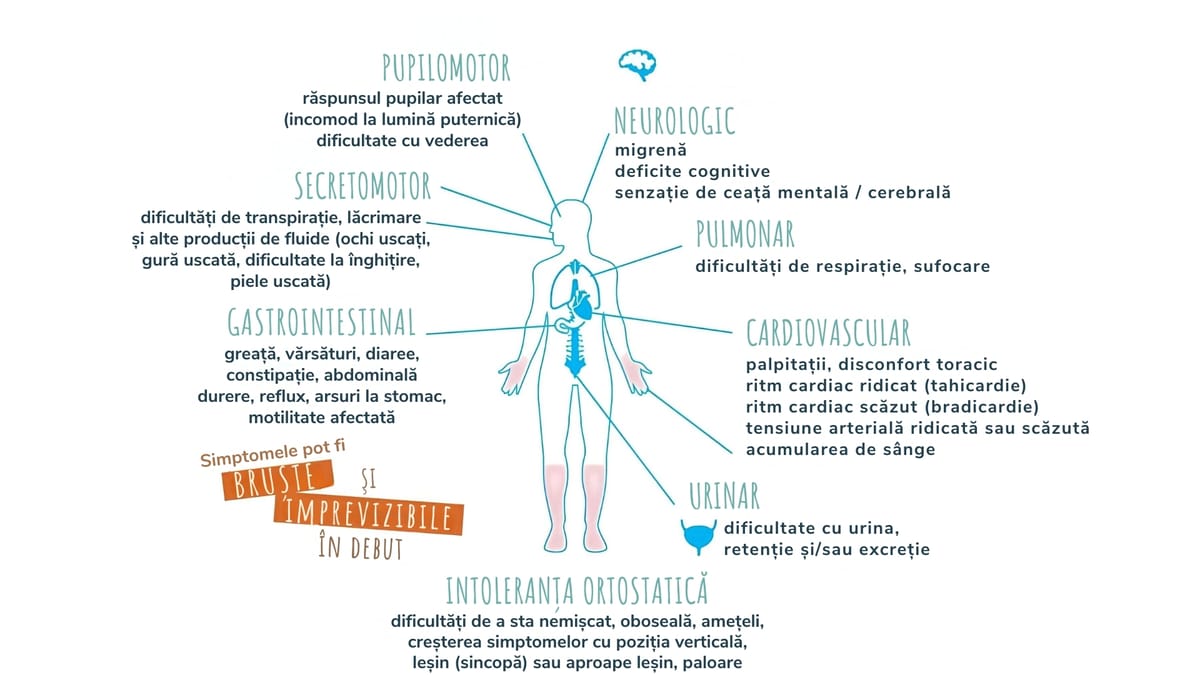
Simptome
Simptomele pot include (⁸) (⁹):
- tahicardie ortostatică (creșterea frecvenței cardiace atunci când stați în picioare);
- intoleranță ortostatică (amețeli, vertij, slăbiciune, dificultăți de respirație, strângere în piept, dureri în piept, palpitații cardiace și/sau tremurături);
- oboseală;
- simptome autonome (generate de disfuncția sistemului nervos autonom/vegetativ(de exemplu: acumulare de sânge - staza sangvina/încetinirea circulației, simptome gastrointestinale, transpirație crescută sau scăzută - intensă sau mai scăzută decât în mod obișnuit)
- dureri de cap;
- disfuncție cognitivă (“ceață” cerebrală);
- durere (difuză);
- tulburări de somn;
- toleranță scăzută sau Intoleranță la efort.
Incidență/cauză
Mai mult de 75% dintre pacienții cu POTS sunt femei (¹²) (¹³), iar vârsta medie de debut este între 15 și 25 de ani (¹⁴).
Nu toată lumea este capabilă să identifice o cauză, un factor declanșator sau un eveniment precipitant pentru POTS. Cu toate acestea, pentru unele persoane, debutul simptomelor a avut loc după boli/infecții virale, o intervenție chirurgicală, o comoție cerebrală (AVC) sau în timpul sau după sarcină (¹⁵) (¹⁶) (¹⁷).
Cercetătorii au constatat că POTS apare frecvent împreună cu alte afecțiuni, cum ar fi (¹⁸) (¹⁹) (²⁰):
- sindromul oboselii cronice (Chronic Fatigue Syndrom - CFS);
- neuropatia fibrelor mici;
- tulburarea de activare a mastocitelor (MCAS);
- sindromul Ehlers-Danlos hipermobil;
- migrenele;
- disfuncțiile gastrointestinale (de ex. sindromul colonului iritabil);
- tulburările autoimune;
- fibromialgia.
Subtipuri
Există diferite procese fiziopatologice care conduc la clasificarea în diferite subtipuri de POTS. Cunoașterea Subtipurilor POTS poate ajuta la înțelegerea mecanismelor care conduc la disfuncția autonomă și la simptomele observate în această afecțiune.
Este important de cunoscut/evidențiat faptul că în rândul comunității medicale nu există criterii acceptate în mod uniform pentru fiecare subtip (¹).
De asemenea, pacienții adesea nu se încadrează într-un singur subtip. Unele cadre medicale nu le vor atribui pacienților un subtip în momentul diagnosticării. Acest lucru se datorează faptului că tratamentul trebuie adesea să fie individualizat pentru fiecare pacient și, uneori, oamenii prezintă manifestări care aparțin mai multor subtipuri (²²) (²³).
Cu toate acestea, vom împărtăși înțelegerea actuală a diferitelor subtipuri.
Principalele subtipuri de POTS sunt POTS hiperadrenergic (denumit uneori "Hyper POTS"), POTS neuropatic, POTS hipovolemic și POTS mediat imun sau autoimun (²⁴) (²⁵).
- POTS hiperadrenergic poate fi caracterizat prin tahicardie excesivă la ridicarea în picioare, o creștere a tensiunii arteriale sistolice cu peste 10 mmHg și niveluri crescute ale norepinefrinei circulante în picioare (²⁶) de 600 pg/mL sau mai mult (²⁷).
- Pacienții cu POTS hiperadrenergic pot prezenta, de asemenea, simptome de activare simpatică, cum ar fi palpitații, transpirație, greață și dureri abdominale (²⁸).
- POTS-ul hiperadrenergic poate fi secundar unei alte forme de POTS cum ar fi hipovolemic sau neuropatic (²⁹).
POTS neuropatic prezintă adesea unele disfuncții cu denervare simpatică, de obicei o neuropatie a fibrelor mici (³⁰). Acestea se pot prezenta sub forma unor zone de piele care nu prezintă capacitatea de a transpira (³¹) (³²).
Denervarea simpatică observată în cazul POTS neuropatică poate duce la acumularea de sânge la nivelul membrelor inferioare și al abdomenului (³³).
În urma acumulării de sânge, mai puțin sânge poate ajunge înapoi la inimă, ceea ce are ca și consecință creșterea frecvenței cardiace, prin activarea sistemului nervos simpatic (³⁴).
POTS hipovolemic se referă la pacienții care au un deficit al volumului total de sânge (³⁵). Cercetătorii au descoperit că unele persoane cu POTS pot avea o scădere cu aproximativ 13% a volumului plasmatic comparativ cu persoanele sănătoase (³⁶).
Se crede că aceste persoane ar putea avea o dereglare a sistemului renină-angiotensină-aldosteron (RAA) și o scădere a metabolismului angiotensinei II, care contribuie la retenția deficitară a sodiului și la scăderea volumului de lichide care ar trebui reatenționate în mod uzual de către organism prin intermediul funcției rinichilor (³⁷) (³⁸).
Sistemul RAA acționează pentru a menține un nivel adecvat al volumului sanguin prin creșterea reabsorbției de sodiu, a reabsorbției de apă, precum și prin creșterea tonusului vascular (³⁹). După cum s-a menționat mai sus, hipovolemia poate cauza/apărea sub forma POTS hiperadrenergic. La aceste persoane, organismul compensează scăderea volumului sanguin prin creșterea foarte intensă a activării simpatice centrale.
POTS mediat imun se referă la pacienții care raportează debutul simptomelor după o boală virală acută sau împreună cu unele afecțiuni autoimune, sugerând că factorii autoimuni ar putea juca un rol în dezvoltarea POTS (⁴⁰) (⁴¹).
Pacienții cu POTS au o frecvență mai mare a tulburărilor autoimune, precum sindromul Sjögren, lupusul, boala celiacă și artrita reumatoidă (⁴²) (⁴³).
Studiile au raportat prezența unor autoanticorpi și a unor markeri autoimuni nespecifici la persoanele cu POTS. Cu toate acestea, sunt necesare mai multe cercetări pentru a înțelege legătura dintre prezența acestora și apariția POTS acestor anticorpi (⁴⁴).
Diagnosticul
„Standardul de aur" actual pentru diagnosticarea POTS este testul TTT (Tilt Table Test = Testul cu masă înclinată) (⁴⁵).
Este utilă efectuarea unor teste suplimentare pentru a exclude alte posibile cauze ale tahicardiei ortostatice (de exemplu, analize de sânge de rutină, monitorizare Holter, etc.), însă acestea nu sunt strict necesare pentru diagnosticarea POTS (⁴⁶).
De asemenea, unele persoane cu POTS pot efectua unele teste suplimentare (de exemplu, QSART - Quantitative Sudomotor Axon Reflex Test - un test care evaluează funcția nervilor implicați în procesul de transpirație, nivelul plasmatice al norepinefrinei), dar acestea nu reprezintă recomandări de rutină conform ghidurilor actuale (⁴⁷).
Tratament
POTS poate fi gestionat prin metode farmacologice și non-farmacologice. Adesea, tratamentul începe cu adaptarea stilului de viață, precum creșterea aportului de sare și apă, învățarea unor manevre fizice de contracarare a simptomelor, purtarea de îmbrăcăminte de compresie și antrenamentul fizic (⁴⁸) (⁴⁹).
În cazul în care intervențiile non-farmacologice nu reușesc să determine reducerea simptomelor, se va lua în considerare o abordare farmacologică, prin utilizarea medicamentelor.
Diferite medicamente pot fi prescrise pentru a determina creșterea volumului lichidelor din organism (Fludrocortizon), a crește tonusul vaselor de sânge (Midodrine) și/sau pentru a reduce frecvența cardiacă (beta-blocante) (⁵⁰) (⁵¹) (⁵²).
Vă rugăm să rețineți că acestea sunt câteva exemple de medicamente utilizate în tratamentul POTS și nu o listă exhaustivă.
Resurse suplimentare:
Postural Orthostatic Tachycardia Syndrome (POTS) by Brent P. Goodman, M.D. - YouTube GIBLIB
POTS: Therapeutic Options: Blair Grubb, MD- Dysautonomia International Diagnosis and Management of POTS, 2017- Dysautonomia International

Postural Orthostatic Tachycardia Syndrome: JACC Focus Seminar - Journal of the American College of Cardiology

Hipotensiunea Ortostatică / Orthostatic Hypotension (OH)
Hipotensiunea ortostatică (OH) este definită ca fiind o scădere a tensiunii arteriale determinată de schimbarea poziției corpului, la ridicarea în picioare. În această situație, organismul persoanelor cu OH nu este capabil să mențină o tensiune arterială adecvată pentru a trimite suficient sânge la creier (⁵³).
OH poate fi acută (apare doar de câteva ori și apoi dispare de la sine) sau cronică (episoadele durează mai mult și apar mai frecvent) (⁵⁴).
OH poate fi, de asemenea, asimptomatică (adică nu se observă simptome ale scăderii tensiunii arteriale) sau manifestă clinic (⁵⁵) (⁵⁶) (⁵⁷).
Criterii de diagnostic (⁵⁸) (⁵⁹)
- Scăderea TA sistolice cu >20 mmHg SAU scăderea TA diastolice cu >10 mmHG în decurs de 3 minute de la statul în picioare (sau cu 60 de grade de înclinare pe un test cu masă înclinată) la persoanele normotensive (având TA de fond normală).
- Scăderea TA sistolice cu >30 mmHg sau scăderea TA diastolice cu >15 mmHg în aceleași condiții la persoanele hipertensive.
Simptome
Simptomele hipotensiunii ortostatice includ (⁶⁰) (⁶¹) (⁶²):
- amețeală;
- sincopă/lipotimie (pre-sincopă);
- senzație de oboseală;
- vedere încețoșată;
- senzație de ceață cerebrală;
- slăbiciune;
- greață;
- dureri de cap;
- palpitații;
- dureri toracice;
- dificultăți de respirație.
Incidență / Prevalență
OH apare la aproximativ 6% din populația generală (⁶³). Cu toate acestea, frecvența crește odată cu vârsta și cu prezența comorbidităților. La cei peste 65 de ani, prevalența ajunge la aproximativ 20% (⁶⁴) (⁶⁵).
Tipuri / Cauze
Hipotensiunea ortostatică poate fi clasificată ca OH non-neurogenă și OH neurogenă (nOH).
- OH non-neurogenă este cea mai frecventă formă de OH. Aceasta este cauzată de obicei de hipovolemie (volum sanguin scăzut), insuficiență a pompei cardiace (probleme cu pomparea eficientă a inimii), stază venoasă (stagnarea sângelui la nivelul extremităților inferioare) și de anumite medicamente (⁶⁶). OH non-neurogenă poate frecvent remite pe deplin în situațiile în care cauza care stă la baza ei este identificată și poate fi rezolvată. Există și unele situații în care cauza nu poate fi remediată, precum unele forme de insuficiență cardiacă (⁶⁷) (⁶⁸) (⁶⁹).
- Hipotensiunea ortostatică neurogenă (nOH) se produce atunci când există un nivel insuficient de vasoconstricție, cauzat de scăderea transmisiei noradrenergice, printr-o disfuncție a sistemului nervos autonom (⁷⁰) (⁷¹). nOH este frecvent întâlnită la persoanele în vârstă cu afecțiuni neurodegenerative precum boala Parkinson (PD), demența cu corpi Lewy (DLB) și forme mai rare de disautonomie precum atrofia multiplă a sistemului (MSA) și insuficiența autonomă pură (PAF) (⁷²) (⁷³). Aceste persoane prezintă o scădere constantă și severă a tensiunii arteriale la ridicarea în picioare din cauza insuficienței autonome, dar este posibil și să nu aibă o creștere corespunzătoare a ritmului cardiac pentru a compensa (⁷⁴) (⁷⁵).
- Pacienții cu OHN prezintă de obicei simptome mai severe decât cei cu OH non-neurogen (⁷⁶). Unii pacienți pot prezenta simptome hipotensive după ce consumă alimentele din cadrul meselor (⁷⁷). Aproximativ jumătate dintre persoanele cu nOH prezintă o tensiune arterială crescută atunci când sunt culcate (hipertensiune în supinație) (⁷⁸). Hipertensiunea în supinație poate deveni severă, determinând creșterea marcată a diurezei, în special noaptea (urinare frecventă noaptea) (⁷⁹) (⁸⁰) (⁸¹). Creșterea diurezei poate ulterior să agraveze simptomele OH ortostatice din cauza reducerii lichidelor din organism (⁸²). Oscilația largă a valorilor tensiunii arteriale în cazul modificărilor poziționale poate diminua calitatea vieții prin agravarea simptomelor, mai ales a leșinului, a leziunilor cauzate de cădere precum și prin apariția fricii de cădere (⁸³) (⁸⁴) (⁸⁵).
*Ambele forme de hipotensiune ortostatică se pot clasifica, în funcție de momentul manifestării lor, ca inițială, clasică sau tardivă (⁸⁶) (⁸⁷) (⁸⁸).
- OH inițială implică o scădere a tensiunii arteriale în aproximativ 15 secunde de la ridicarea în picioare.
- OH clasic implică o scădere a tensiunii arteriale în decurs de 3 minute de la ridicarea în picioare.
- OH întârziată implică o scădere a tensiunii arteriale după 3 minute de la ridicarea în picioare.
Diagnosticul
Diagnosticul se stabilește de obicei prin evaluarea semnelor vitale la ridicarea și în timpul statului în picioare. Acest lucru se poate face folosind un pat sau o masă specială care se poate înclina.
O serie de teste care sunt uneori utilizate pentru a diferenția OH neurogenă de OH non-neurogenă includ:
- Manevra Valsalva;
- Evaluarea reflexelor autonome;
- Monitorizarea ambulatorie repetată a tensiunii arteriale;
- Testul termoregulator al transpirației;
- Măsurarea norepinefrinei în decubit dorsal și în picioare și a sodiului urinar pe 24 de ore (⁸⁹).
Tratament
Multe dintre tratamentele pentru nOH și OH cronică, simptomatică non-neurogenă sunt similare. Acestea includ metode farmacologice și nefarmacologice care vizează reducerea simptomelor, îmbunătățirea tensiunii arteriale ortostatice fără exacerbarea hipertensiunii în decubit dorsal, creșterea adaptabilității la ridicarea în picioare (⁹⁰) (⁹¹).
Mijloacele non-farmacologice includ evitarea meselor copioase, limitarea consumului de alcool, creșterea aportului de lichide pentru echilibrarea pierderilor, creșterea cantității de sodiu ingerate (prin aport alimentar și/sau suplimente), purtarea unor ciorapi de compresie, aplicarea unor contra-manevre care să ajute la creșterea tensiunii arteriale și un program de exerciții fizice (⁹²) (⁹³) (⁹⁴).
În plus, creșterea înălțimii capului patului pe timpul nopții poate ajuta la reducerea hipertensiunii dorsale, a diurezei nocturne și a pierderii de sodiu datorate diurezei nocturne (⁹⁵) (⁹⁶) (⁹⁷). Scăderea consumului de băuturi diuretice, cum ar fi cafeaua, ceaiul, sucurile și alcoolul, va ajuta la reținerea volumului de lichid care ar fi fost pierdut prin urinare (⁹⁸).
Medicamente care se concentrează pe creșterea volumului de lichide (Fludrocortizon), constricția vaselor de sânge (Midodrină) și îmbunătățirea neurotransmisiei acetilcolinei care declanșează reflexul care controlează tensiunea arterială (Mestinon) (⁹⁹). Droxidopa a fost aprobată de FDA pentru hipotensiunea ortostatică neurogenă (¹⁰²).
În cazul OH acută, non-neurogenă, tratamentul implică, în general, tratarea cauzei subiacente, care va rezolva apoi, de obicei, OH (¹⁰³). Dacă aceasta nu poate fi rezolvată, atunci se recomandă strategiile de mai sus.
Tratamentul nOH este adesea complicat de hipertensiunea în decubit dorsal și de alți factori.
De exemplu, eforturile de creștere a tensiunii arteriale și a volumului de lichide în timpul zilei pot agrava hipertensiunea supină pe timp de noapte, iar tratamentele de reducere a hipertensiunii de supinație pe timp de noapte pot agrava intoleranța la ortostatism în timpul zilei (¹⁰⁴).
Factorii care agravează OH, cum ar fi utilizarea medicamentelor cu efecte hipotensoare, prezența anemiei, deshidratarea și deficiențele vitaminice, trebuie evaluați și corectați (¹⁰⁵). Fiecare pacient cu nOH trebuie să fie evaluat ca un întreg și tratat în funcție de condiția sa individuală. Cu evaluare și tratament adecvat și continuu, simptomele se pot diminua, iar persoanele cu nOH pot avea o calitate mai bună a vieții.
Resurse suplimentare:
Neurogenic Orthostatic Hypotension - Medical Animation - YouTube
How can you increase blood pressure if you have hypotension? - Top Doctors UK YouTube.
Orthostatic Hypotension (Postural Hypotension) - Dr. Najeeb Lectures
How can tilting the bed up help people with orthostatic hypotension - MSA Coalition



Sincopa Vasovagală / VasoVagal Syncope (VVS)
Sincopa, sau leșinul/leșinul, este o problemă frecventă, determinată de multiple cauze diferite. Ea se manifestă ca o pierdere temporară a cunoștinței însoțită de incapacitatea de a menține tonusul postural (¹⁰⁶).
Unele persoane nu sunt capabile să determine cauza exactă a sincopelor lor, iar multe au un singur episod în întreaga lor viață. Alte persoane pot avea episoade recurente de leșin, cauzate de obicei de sincope prin mecanisme reflexe, cum ar fi sincopa vasovagală sau sincopa cardiacă (¹⁰⁷).
Sincopa vasovagală (VVS), cunoscută și sub denumirea de sincopă mediată neuronal (NMS), este o formă de sincopă în care sistemul nervos autonom nu reușește brusc să mențină un tonus vascular adecvat, ceea ce duce la hipotensiune (tensiune arterială scăzută) și bradicardie (ritm cardiac scăzut), provocând pierderea temporară a stării de conștiență (¹⁰⁸). Stresul determinat de ortostatismul prelungit este de obicei principalul declanșator al unui episod de sincopă vasovagală (¹⁰⁹).
Criterii de diagnostic (¹¹⁰)
- Episodul sincopal este declanșat de statul în picioare mai mult de 30 de secunde, durere, stres emoțional sau alt stimul specific.
- Există o scădere a tensiunii arteriale și a ritmului cardiac.
- Sunt experimentate simptome precum transpirația, căldura și greața.
- Episodul este urmat de o stare de oboseală, epuizare.
Simptome
Sincopa poate fi precedată de o perioadă în care individul experimentează simptome cunoscute sub numele de lipotimie (presincopă), care apar înainte de a-și pierde cunoștința.
Simptomele lipotimiei (pre-sincopei) pot include (¹¹¹) (¹¹²):
- senzație de căldură;
- tremurături, frisoane;
- transpirație;
- înroșirea sau paloarea tegumentelor;
- greață;
- încețoșarea sau pierderea vederii;
- modificări ale auzului.
De obicei, în timpul perioadei de pierdere a conștienței persoana este nemișcată; cu toate acestea, mișcări mioclonice fine și grosiere, precum tremurături sau contracturi sacadate ale musculaturii, au fost observate rar, în aproximativ 10% din cazuri (¹¹³) (¹¹⁴).
Starea de pierdere a conștienței durează de obicei doar 1-2 minute, dar recuperarea completă poate fi lentă și poate dura de la câteva minute la câteva ore (¹¹⁵). După evenimentul sincopal, individul experimentează oboseală intensă (¹¹⁶) (¹¹⁷).
Incidență/Prevalență
Până la 40% dintre oameni leșină cel puțin o dată în viață (¹¹⁷) (¹¹⁸).
Femeile leșină mai frecvent decât bărbații (¹¹⁹). Aproximativ 14% din toate episoadele sincopale sunt de natură vasovagală (¹²⁰).
Diagnosticul
Următoarele teste pot fi utile atunci când se suspectează o sincopă vasovagală:
- ECG în repaus cu 12 derivații (¹²¹).
- Testare pe masă înclinată (¹²²).
- Monitorizare Holter (¹²³).
- Test de efort cardiac, dacă sincopa apare în timpul efortului (¹²⁴).
Pentru mai multe detalii privind testele enumerate aici, consultați pagina noastră de diagnostic
Tratament (¹²⁵)
Tratamentul pentru sincopa vasovagală începe de obicei cu educarea cu privire la diagnostic și prognostic. În special, educația ar trebui să se concentreze pe evitarea factorilor declanșatori, cum ar fi statul prelungit în picioare, mediile calde și rău aerisite etc.
Manevrele fizice de contrapresiune pot fi utile pentru episoadele presincopale pentru a evita pierderea conștienței.
O creștere a aportului de sare și lichide poate fi utilă în gestionarea simptomelor. Dacă sincopa continuă, pot fi necesare medicamente. Midodrina, Fludrocortizonul, beta-blocantele și/sau inhibitorii selectivi ai recaptării serotoninei (SSRI) pot fi utile.
Resurse suplimentare:
Vasovagal Syndrome - York Cardiology
Counterpressure maneuver for low blood pressure - Arrhythmia Alliance


Tahicardia sinusală (IST)
Tahicardia sinusală (TS) este o afecțiune cronică în care frecvența cardiacă a individului este mai mare de 100 de bătăi pe minut (bpm) în repaus (¹²⁶).
De obicei, o frecvență cardiacă normală în repaus este cuprinsă între 60-100 bătăi pe minut (bpm) (¹²⁷).
Cuvântul "sinusal" se referă la un ritm cardiac sinusal, care este tipul normal, sănătos de ritm cardiac (¹²⁸).
Aceasta înseamnă că, în TS, inima bate în ritmul său normal, dar bate în mod constant la o rată mai mare decât cea normală.
Criterii de diagnostic (¹²⁹)
- Frecvența cardiacă medie trebuie să fie mai mare de 90 bpm pentru o perioadă de 24 de ore, inclusiv în repaus. Ritmul cardiac trebuie să fie sinusal;
- Este necesară excluderea altor cauze ale tahicardiei;
- Pacientul trebuie să prezinte simptome deranjante, precum cele de palpitații.
Spre deosebire de multe dintre celelalte forme de disautonomie, TS nu este o formă de intoleranță ortostatică (¹³⁰).
Aceasta înseamnă că simptomele și frecvența cardiacă crescută nu depind de poziția corpului.
Cu toate acestea, cu un efort minim, IST (indiferent de modificările poziționale) poate determina creșterea excesivă a frecvenței cardiace (¹³¹) (¹³²).
Simptome
Cel mai important și frecvent simptom al IST sunt palpitațiile (¹³³) (¹³⁴).
Alte simptome includ: slăbiciune, oboseală, amețeli, intoleranță la efort, dificultăți de respirație, lipotimie (presincopă) și sincopă (¹³⁵) (¹³⁶) (¹³⁷).
Incidență
Conform estimărilor recente, 1,2% din populație are IST (¹³⁸).
Diagnosticul
Diagnosticul de IST este un diagnostic de excludere, ceea ce înseamnă că alte cauze ale ritmului cardiac ridicat sunt analizate și excluse înainte de a obține diagnosticul de IST (¹³⁹) (¹⁴⁰) (¹⁴¹).
Cele mai frecvente teste utilizate pentru diagnosticarea IST sunt un EKG cu 12 derivații și monitorizarea holter de 24 de ore (¹⁴²).
Tratament
Ca și în cazul multor alte forme de disautonomie, tratamentele de primă linie pentru IST sunt modificările stilului de viață care includ evitarea factorilor declanșatori ai IST și a medicamentelor stimulante (¹⁴³).
Dincolo de aceasta, unele medicamente care scad ritmul cardiac sunt adesea utilizate pentru a gestiona simptomele (în special ivabradina) (¹⁴⁴) (¹⁴⁵). Ivabradina poate fi utilizată și în asociere cu un beta-blocant (¹⁴⁶).
Intervențiile asupra nodului sinusal în cazurile de rutină nu sunt recomandate de actuala declarație de consens pentru IST (¹⁴⁷).
Ca multe alte forme de disautonomie, sunt necesare mai multe cercetări în acest domeniu.
Resurse suplimentare
Inappropriate Sinus Tachycardia - York Cardiology
Inappropriate Sinus Tachycardia - Arrhythmia Alliance
Gangliopatia Autonomă Autoimună / Autoimmune Autonomic Gangliopathy (AAG)
Gangliopatia autonomă autoimună (AAG), cunoscută și sub numele de pandisautonomie acută sau neuropatie autonomă subacută idiopatică, este o formă rară de disautonomie (¹⁴⁸).
Unii pacienți pot prezenta un debut rapid, în timp ce la alții se observă o manifestare progresivă a simptomelor (¹⁴⁹).
Simptome
Simptomele sunt reprezentative pentru insuficiența autonomă a sistemelor nervos simpatic, parasimpatic și enteric (¹⁵⁰).
Cel mai răspândit simptom asociat cu AAG este hipotensiunea ortostatică (OH) (¹⁵¹). Alte simptome pot include (¹⁵²):
- uscăciunea ochilor și a gurii;
- pupila lui Adie (pupile tonice, cu reacție lentă);
- gastropareză;
- vezica neurogenă (disfuncție a vezicii urinare care poate include incontinență prin supra-plin, frecvență, presiune sau fenomene de retenție urinară) (¹⁵³) (¹⁵⁴);
- parestezii (senzații de arsură sau de înțepătură la nivelul extremităților).
Incidență/Prevalență
AAG afectează de obicei persoanele de vârstă mijlocie și afectează femeile mai des decât bărbații (¹⁵⁵).
Diagnosticul
AAG poate fi diagnosticată după o anamneză completă, un examen medical și teste care evaluează funcția sistemului nervos autonom (¹⁵⁶).
Unii pacienți cu AAG au niveluri ridicate de anticorpi pentru receptorul nicotinic ganglionar al acetilcolinei (gAChR) (¹⁵⁷). Se crede că acești anticorpi lezează receptorii din ganglionii autonomi, o parte a fibrei nervoase autonome periferice. Acest lucru interferează cu transmiterea autonomă, ducând la insuficiența autonomă (¹⁵⁸) (¹⁵⁹).
Tratamentul
Tratamentul AAG vizează patologia mediată de anticorpi, deși nu există un protocol de tratament clar stabilit.
Tratamentul acestei forme de disautonomie se concentrează de obicei pe tratarea simptomelor asociate (¹⁶⁰) (¹⁶¹).
Primul tratament adesea utilizat în cazul AAG este scăderea până la eliminarea titrului de anticorpi prin efectuarea procedurii de plasmafereză și prin administrarea intravenoasă de imunoglobuline (IVIG) (¹⁶²). Medicamentele imunosupresoare și corticosteroizii pot fi utilizate împreună cu procedurile de depleție de anticorpi (¹⁶³).
Lacrimile artificiale pentru gura și ochii uscați pot fi utilizate cu succes pentru a trata aceste simptome specifice (¹⁶⁴) (¹⁶⁵).
Unii pacienți prezintă o recuperare spontană fără tratament, deși pentru mulți, recuperarea este adesea incompletă și prezintă un anumit nivel de simptome de-a lungul vieții (¹⁶⁶).
Resurse suplimentare:
Autoimmune Autonomic Ganglionopathy - Steven Vernino, MD, PhD - Dysautonomia International
Rare Dysautonomias with Dr. Glen Cook - Dysautonomia International

Eșecul Baroreflexului / Baroreflex Failure (BF)
Eșecul baroreflexului (BF) este o formă rară de disfuncție autonomă în care mecanismele baroreflexe nu funcționează corect.
Baroreflexele sunt importante pentru reglarea tensiunii arteriale (¹⁶⁶). Atunci când este activat, baroreflexul trimite semnale electrice la creier, unde sunt interpretate împreună cu alte informații primite de la organism (¹⁶⁷).
Atunci când tensiunea arterială este prea ridicată, baroreflexul stimulează sistemul nervos parasimpatic și îl inhibă pe cel simpatic (¹⁶⁸), determinând astfel scăderea frecvenței cardiace și vasodilatarea vaselor de sânge, scăzând astfel riscul unor evenimente cardiovasculare precum AVC.
Opusul se întâmplă atunci când tensiunea arterială este prea scăzută.
Cauza
La persoanele cu eșecul baroreflexului, există leziuni ale structurilor specifice responsabile de transmiterea informațiilor prin impulsuri nervoase către creier (¹⁶⁹).
Ceea ce înseamnă că creierul nu este capabil să primească semnalele de la organism privind starea tensiunii arteriale și, prin urmare, nu o poate regla bine (¹⁷⁰).
Afecțiunea este adesea cauzată de traumatisme suferite în urma unei intervenții chirurgicale extinse la nivelul gâtului sau a iradierii gâtului cu anumite terapii împotriva cancerului (¹⁷¹).
Cauza exactă nu poate fi determinată pentru unii pacienți (¹⁷²) (¹⁷³) (¹⁷⁴). Debutul poate fi brusc sau mai treptat, debutul acut fiind mai frecvent observat în cazul intervențiilor chirurgicale la gât (¹⁷⁵) (¹⁷⁶).
Simptome (¹⁷⁷)
- hipertensiunea sau hipotensiune arterială;
- fluctuația tensiunii arteriale;
- sincopă;
- tahicardie sau bradicardie;
- cefalee;
- înroșirea tegumentelor.
Eșecul baroreflexului se poate manifesta prin fluctuații ale tensiunii arteriale pe parcursul zilei și poate include episoade hipertensive (tensiune arterială ridicată) și episoade hipotensive (tensiune arterială scăzută) (¹⁷⁸).
În timpul episoadelor hipertensive, pacienții pot prezenta o tensiune arterială cuprinsă între 170-280/110-135 mmHg, frecvență cardiacă ridicată, senzație de căldură sau înroșirea tegumentelor, dureri de cap și transpirație excesivă (¹⁷⁹). Aceste episoade sunt adesea declanșate de stresul psihologic, emoții, exerciții fizice și durere.
Episoadele hipotensive sau de tensiune arterială scăzută sunt mai puțin frecvente, dar pot implica bradicardie (scăderea ritmului cardiac) și simptome de lipotimie (presincopă) (¹⁸⁰) (¹⁸¹) (¹⁸²).
Este important de reținut că hipotensiunea ortostatică nu este de obicei un simptom al eșecului baroreflexului, ci poate fi un semn al disfuncției vegetative/autonome pure. Persoanele cu eșecul baroreflexului pot prezenta hipotensiune ortostatică în condiția scăderii volumului circulant (al sângelui) sau dacă le sunt administrate medicamente simpatolitice (¹⁸³).
Incidență/prevalență
Eșecul baroreflexului este o formă rară de disautonomie care afectează mai puțin de 200 000 de persoane în SUA (¹⁸⁴)
Incidență/prevalență
Eșecul baroreflexului este o formă rară de disautonomie care afectează mai puțin de 200.000 de persoane în SUA (¹⁸⁴).
Diagnosticul
Eșecul baroreflexului se diagnostichează prin efectuarea unui examen clinic complet și a unei anamneze atente, prin evaluarea frecvenței cardiace și a tensiunii arteriale ca răspuns la anumite medicamente (¹⁸⁵), dozarea norepinefrinei plasmatice venoase (¹⁸⁶) și testarea funcției sistemului nervos autonom (¹⁸⁷).
Evaluarea funcției autonome poate include (¹⁸⁸):
- Monitorizarea ambulatorie a tensiunii arteriale.
- Evaluarea răspunsului la Manevra Valsalva (constatarea absenței modificărilor așteptate ale frecvenței cardiace).
- Testul presor la rece (apariția unui răspuns presor exagerat).
Tratamentul
Scopul principal al tratamentului pentru cei cu eșecul baroreflexului este prevenirea apariției hipertensiunii arteriale extreme. Medicamentele, precum Clonidina, pot fi utilizate pentru a ajuta la reducerea tensiunii arteriale (¹⁸⁹) (¹⁹⁰).
Un obiectiv secundar este reducerea simptomelor de hipotensiune arterială dacă este necesar (¹⁹¹) (¹⁹²). Fludrocortizonul poate fi util în atingerea acestui obiectiv (¹⁹³) (¹⁹⁴).
Unele persoane au nevoie, de asemenea, de implantarea unor stimulatoare cardiace în contextul apariției unor episoade severe și debilitante de hipotensiune arterială și/sau de bradicardie (¹⁹⁵). Trebuie să discutați cu medicul dumneavoastră cu privire la modul în care medicamentele pot influența capacitatea organismului de a regla și controla tensiunea arterială în cazul în care aveți eșec baroreflex (¹⁹⁶) (¹⁹⁷). Anumite medicamente sunt contraindicate din cauza potențialelor efecte adverse severe (¹⁹⁸).
Resurse suplimentare:
Regulation of blood pressure with baroreceptors | NCLEX-RN - Khan Academy
Academy Baroreflex Regulation of Blood Pressure - Alila Medical Media
21.4 Baroreflex - UChicago Online
Disautonomia familială / Familial Dysautonomia (FD)
Disautonomia familială (FD) este cunoscută și sub numele de sindromul Riley-Day.
Aceasta este o tulburare genetică rară și doar aproximativ 350 de persoane din întreaga lume trăiesc cu FD în prezent (¹⁹⁹).
Din cele constatate în literatură, FD apare aproape exclusiv la evreii ashkenazi, deși poate apărea la persoane de orice naționalitate sau rasă.
FD este o tulburare autosomal-recesivă, ceea ce înseamnă că șansele de a moșteni FD sunt de 25% atunci când ambii părinți sunt purtători ai mutației genetice specifice pentru această afecțiune (²⁰⁰).
Simptome
- Scăderea sensibilității la durere;
- Reglarea deficitară a tensiunii arteriale și a temperaturii corpului;
- Crize autonome (vărsături ciclice, tensiune arterială foarte ridicată, frecvență cardiacă ridicată, transpirații excesive, febră);
- Absența secreției lacrimale;
- Incapacitatea de a suge sau de a înghiți (acest lucru poate determina necesitatea montării unui tub de hrănire);
- Creșterea deficitară, în cazul copiilor;
- Alte probleme respiratorii, cardiovasculare, ortopedice, digestive și de vedere.
Persoanele cu disautonomie familială trebuie să consulte Fundația pentru Disautonomie Familială pentru mai multe informații.
Notă: Disautonomia familială este o formă distinctă de disautonomie. În prezent, există speculații cu privire la posibili factori genetici cu impact asupra altor forme de disautonomie (de exemplu, persoane care observă că mai multe persoane din familia lor au disautonomie).
Această situație NU este același lucru cu a avea FD.
Resurse suplimentare:


Pure Autonomic Failure (PAF)
Insuficiența autonomă pură (PAF) este o formă rară de disautonomie (²⁰¹). Este cunoscută și sub numele de sindromul Bradbury-Eggleston și este o disautonomie primară.
PAF provoacă deteriorarea celulelor sistemului nervos autonom și, prin urmare, provoacă disfuncții generale ale acestuia (²⁰²).
Hipotensiunea ortostatică este o caracteristică esențială a PAF. Aceasta este de obicei severă și poate provoca amețeli, lipotimie sau sincopă (²⁰³) (²⁰⁴).
Alte simptome pot include disfuncții genito-urinare, intestinale și de termoreglare (²⁰⁵). De asemenea, cercetări recente au arătat o relație între PAF și dezvoltarea ulterioară a altor afecțiuni, precum MSA, boala Parkinson și demența (²⁰⁶). Vârsta medie de debut este vârsta mijlocie și este mai frecventă la bărbați decât la femei (²⁰⁷).
Simptome
Într-un studiu, participanții au raportat următoarele simptome (²⁰⁸):
- Hipotensiune ortostatică;
- Hipertensiune în decubit dorsal (50%);
- Disfuncție genito-urinară (50%);
- Constipație (58%);
- Anomalii ale transpirației (44%).
Incidență/Prevalență
Insuficiența autonomă pură este o formă rară de disautonomie care afectează mai puțin de 200.000 de persoane în SUA (²⁰⁹).
Diagnosticul
Criteriile oficiale de diagnostic pentru PAF, conform declarației de consens, nu au mai fost actualizate din 1996 (²¹⁰).
Criteriile de diagnostic sunt destul de vagi și includ: hipotensiune ortostatică neurogenă, prezența frecventă a altor simptome autonome și absența altor simptome neurologice (²¹¹).
Hipotensiunea ortostatică neurogenă este diagnosticată prin evaluarea semnelor vitale în condiții de ortostatism (în picioare) (²¹²).
PAF este adesea diagnosticată în cadrul unor unități medicale care au acces la o gamă completă de teste funcționale complexe pentru evaluarea funcției sistemului nervos autonom, pentru a facilita clarificarea diagnosticului. Acestea includ măsurarea nivelurilor plasmatice ale catecolaminelor, evaluarea răspunsului la manevra Valsalva, testarea eficienței baroreflexului, QSART etc. (²¹³).
Tratamentul
Tratamentul pentru PAF implică în principal gestionarea simptomelor, în special controlul fluctuațiilor tensiunii arteriale (²¹⁴).
Pentru a aborda hipotensiunea ortostatică, măsurile non-farmacologice includ creșterea aportului de lichide, a aportului de sare, exercițiile fizice, ridicarea capului patului și utilizarea articolelor de îmbrăcăminte compresive (²¹⁵).
Medicamentele menite să abordeze hipotensiunea ortostatică includ midodrina, droxidopa, fludrocortizonul și piridostigmina (²¹⁶) (²¹⁷). Hipertensiunea în supinație poate fi tratată cu nitroglicerină sau clonidină (²¹⁸).
Alte simptome, precum constipația, sunt tratate mai întâi cu mijloace non-farmacologice, precum creșterea consumului de apă și fibre (²¹⁹) (²²⁰).
Resurse suplimentare:


Atrofia multiplă a sistemului/atrofie sistemică multiplă / Multiple Systemic Atrophy (MSA)
Atrofia multiplă a sistemului (MSA) este o boală neurologică degenerativă rară care provoacă disfuncții autonome și alte simptome neurologice (²¹⁷).
Diagnosticul
Criteriile pentru diagnosticul de MSA sunt următoarele (²¹⁸):
- Insuficiență autonomă, care implică incontinență urinară sau o scădere a tensiunii arteriale în decurs de 3 minute de la ridicarea în picioare, cu cel puțin 30 mm Hg pentru TA sistolică sau 15 mm Hg pentru cea diastolică.
- Răspuns slab al simptomelor la medicamentul levodopa sau un sindrom cerebelos incluzând ataxie a mersului cu disartrie cerebeloasă, ataxie a membrelor sau disfuncție oculomotorie cerebeloasă.
MSA este diagnosticată după excluderea altor diagnostice și se bazează pe caracteristicile clinice (simptome).
Tipuri/simptome
Există două subtipuri de MSA bazate pe cele mai predominante simptome: MSA-P (parkinsonism predominant) și MSA-C (ataxie cerebeloasă predominantă) (²¹⁹). MSA-P este mai frecventă decât MSA-C (²²⁰).
Aproximativ 75% dintre cei cu MSA prezintă hipotensiune ortostatică neurogenă (nOH) (²²¹). În MSA-P, cele mai frecvente semne și simptome includ (²²²):
- rigiditate musculară;
- tremor în repaus;
- dificultate la înghițire;
- lentoare a mișcărilor;
- dificultăți de echilibru și de menținere a posturii.
În cazul MSA-C, cele mai frecvente semne și simptome includ (²²³):
- dificultăți de coordonare în timpul mersului;
- coordonare slabă a mâinilor;
- dificultăți de vorbire;
- tremurături.
Incidență
Se estimează că doar 0,6/100.000 de persoane au această afecțiune (²²⁴).
Tratament (²²⁵)
Tratamentul pentru MSA este axat pe gestionarea simptomelor. Tratamentul non-farmacologic al simptomelor autonome este similar cu alte tipuri de disautonomie și include purtarea de ciorapi de compresie, aport adecvat de sare și apă, înclinarea capului în sus noaptea, consumul de mese mici pe parcursul zilei etc.
Pentru parkinsonism, medicamentele pot include Levodopa sau Amantadina.
Pentru hipotensiunea ortostatică, se poate utiliza Fludrocortizon sau Midodrină.
Pentru incontinența urinară se poate utiliza Oxibutinina sau Desmopresină, în funcție de tipul acesteia.
Coaliția pentru Atrofia Sistemelor Multiple este o organizație non-profit dedicată comunității MSA. Vă rugăm să consultați site-ul lor pentru informații și conținut suplimentar specific MSA.
Resurse suplimentare:

Bibliografie (click pentru a expanda)
Arnold, A. C., Ng, J., & Raj, S. R. (2018). Postural tachycardia syndrome - diagnosis, physiology, and prognosis. Autonomic Neuroscience: Basic & Clinical, 215, 3–11. {15, 18, 22, 24, 26, 29, 31, 33, 40, 45}
Baker, J., & Kimpinski, K. (2017). Management of supine hypertension complicating neurogenic orthostatic hypotension. CNS Drugs, 31, 653-663. {78, 79, 82, 83, 96}
Biaggioni, I., Shibao, C. A., Diedrich, A., Muldowney, J. A. S., Laffer, C. L., & Jordan, J. (2019). Blood pressure management in afferent baroreflex failure. Journal of the American College of Cardiology, 74(23), 2939–2947. {188, 189}
Bryarly, M., Phillips, L. T., Fu, Q., Vernino, S., & Levine, B. D. (2019). Postural orthostatic tachycardia syndrome: JACC focus seminar. Journal of the American College of Cardiology, 73(10), 1207–1228. {19, 21, 25, 28, 34, 48}
Chelimsky, G., & Chelimsky, T. (2020). Non-pharmacologic management of orthostatic hypotension. Autonomic Neuroscience: Basic & Clinical, 229. {91, 93, 97, 99}
Coon, E., Singer, W., & Low, P. (2019). Pure autonomic failure. Mayo Clinic Proceedings, 94(10), 2087-2098. {204, 209, 210, 214, 215, 217, 218, 219, 220, 222, 223}
Familial Dysautonomia Foundation. (2018). About FD. {201, 202, 203}
Fanciulli, A. & Wenning, G. (2014). Clinical Presentation. in Wenning, G., & Fanciulli, A. (Eds.), Multiple system atrophy (11-15). Springer. {228}
Freeman, R. (2008). Neurogenic orthostatic hypotension. New England Journal of Medicine, 358, 615-624. {55, 74, 80}
Genetic and Rare Disease Information Center. (2015). Autoimmune Autonomic Ganglionopathy. National Institutes of Health. {158, 160, 164, 166}
Genetic and Rare Diseases Information Center [GARD] (n.d.). Diseases. National Institutes of Health. {185}
Golden, E. P., & Vernino, S. (2019). Autoimmune autonomic neuropathies and ganglionopathies: Epidemiology, pathophysiology, and therapeutic advances. Clinical Autonomic Research: Official Journal of the Clinical Autonomic Research Society, 29(3), 277–288. {148, 150, 151, 152, 155, 156, 159, 161, 162,163, 165}
Heusser, K., Tank, J., Luft, F. C., & Jordan, J. (2005). Baroreflex failure. Hypertension, 45(5), 834–839. {169, 171, 174, 176, 181, 184, 192}
Jordan, J. (2012). Baroreflex Failure. In Robertson,D., Biaggioni, I., Burnstock, G., Low, P. A., & Paton, J.F.R. (Eds.) Primer on the autonomic nervous system (3rd ed.). (pp. 349-355). Elsevier/AP. {167, 170, 172, 175, 177, 180, 182, 186, 187, 190, 191, 193, 195, 198}
Kaufmann, H. (2017). Droxidopa for symptomatic neurogenic orthostatic hypotension: What can we learn? Clinical Autonomic Research, 27(1), S1-S3. {102}
Ketch, T., Biaggioni, I., Robertson, R., & Robertson, D. (2002). Four faces of baroreflex failure: Hypertensive crisis, volatile hypertension, orthostatic tachycardia, and malignant vagotonia. Circulation, 105(21), 2518–23. {194, 196, 197, 199, 200}
Krisma, F. & Wenning, G. (2014). Epidemiology. in Wenning, G., & Fanciulli, A. (Eds.), Multiple system atrophy (97-119). Springer. {232}
Lanier, J. B., Mote, M. B., & Clay, E. C. (2011). Evaluation and management of orthostatic hypotension. American family physician, 84(5), 527–536. {61, 67, 75,77, 92, 94, 100, 103}
Lei, L., Chew, D., & Raj, S. (2020). Differential diagnosis of orthostatic hypotension. Autonomic Neuroscience: Basic & Clinical, 228. {54, 59, 64, 85}
Low, P. (2020). Pure autonomic failure. Merck manual consumer version. {205, 206, 207, 221, 224}
Low, P. A. (2015). Neurogenic orthostatic hypotension: Pathophysiology and diagnosis. The American Journal of Managed Care, 21(13), 248–57. {57, 62, 66, 68, 81, 84, 90}
National Organization for Rare Diseases [NORD]. (2018). Pure Autonomic Failure. {208, 211}
Palma, J. A., & Kaufmann, H. (2017). Epidemiology, diagnosis, and management of neurogenic orthostatic hypotension. Movement Disorders Clinical Practice, 4(3), 298–308. {65, 69, 70, 73, 95, 98, 101, 104, 105}
Raj, S. (2013). Postural tachycardia syndrome. Circulation, 127(23), 2336-2342. {35, 38}
Raj, S. R., Biaggioni, I., Yamhure, P. C., Black, B. K., Paranjape, S. Y., Byrne, D. W., & Robertson, D. (2005). Renin-aldosterone paradox and perturbed blood volume regulation underlying postural tachycardia syndrome. Circulation, 111(13), 1574–82. {36}
Raj, S. R.. (2006). The postural tachycardia syndrome (pots): Pathophysiology, diagnosis & management. Indian Pacing and Electrophysiology Journal, 6(2), 84–99. {23}
Ricci, F., De Caterina, R., & Fedorowski, A. (2015). Orthostatic hypotension: Epidemiology, prognosis, and treatment. Journal of the American College of Cardiology, 66(7), 848–860. {53, 63, 85, 89, 216}
Robertson, D. (1999). The epidemic of orthostatic tachycardia and orthostatic intolerance. American Journal of Medical Sciences, 317, 75-77. {10}
Robertson, D., Diedrich, A., & Chapleau, M. (2012). Afferent baroreflex failure. Autonomic Neuroscience, 172(1-2), 1-3. {168, 178, 179}
Robertson, D., Hollister, A. S., Biaggioni, I., Netterville, J. L., Mosqueda-Garcia, R., & Robertson, R. M. (1993). The diagnosis and treatment of baroreflex failure. The New England Journal of Medicine, 329(20), 1449–55. {183}
Sakalni, P., Krahn, A., & Klein, G. (2013). Syncope. Circulation, 127(12), 1330-1339. {109, 117, 120}
Seladi-Schulman, J. (2018). Understanding sinus rhythm. Healthline. {128}
Sheldon, R. (2015). How to differentiate syncope from seizure. Cardiology Clinics, 33(3), 377–85. {114, 115, 118}
Sheldon, R. S., Grubb, B. P., Olshansky, B., Shen, W. K., Calkins, H., Brignole, M. Raj, S. R., Krahn, A.,D., Morillo, C.A., Stewart, J., M., Sutton, R., Sandroni, P., Friday, K.J., Hachul, D., T., Cohen, M., I., Lau, D. H., Mayuga, K. A., Moak. J. P., Sanhu, R., Kanjwal, K. (2015). 2015 heart rhythm society expert consensus statement on the diagnosis and treatment of postural tachycardia syndrome, inappropriate sinus tachycardia, and vasovagal syncope. Heart Rhythm, 12(6), 41–63. {8, 13, 14, 47, 51, 110, 111, 113, 116, 122, 126, 129, 130, 132, 134, 137, 138, 142, 145, 147}
Stewart, J. M. (2013). Common syndromes of orthostatic intolerance. Pediatrics, 131(5), 968–80. {71}
The Dysautonomia Project. (n.d.). Identifying dysautonomia.{1}
The MSA Coalition (2019). Evaluation and treatment guide.{230, 231}
The MSA Coalition (2020). Multiple system atrophy: Types and symptoms. {225, 227}
Vernino, S. (2015). Autoimmune autonomic ganglionopathy: Bench to bedside. Autonomic Neuroscience: Basic and Clinical, 192, 14–14. {149, 154, 157}
Zhao, S. & Tran, V. H. (2020). Postural Orthostatic Tachycardia Syndrome (POTS). StatPearls Publishing [Internet]. {5, 27, 52}
Dacă sunteți o persoană în căutare de îndrumare pentru dvs. și/sau pentru o altă persoană aflată în grija dvs., este esențial să consultați direct un medic sau un specialist în sănătate mintală calificat pentru a primi sfaturi personalizate și adaptate specificităților situației personale. Această abordare asigură că veți beneficia de o îndrumare profesională înțeleaptă și cu adevărat relevantă pentru nevoile dvs. unice. Puteți găsi o listă de recomandări din comunitate pe site-ul DoctorADHD.com
Dacă sunteți un profesionist, accentuăm importanța angajamentului dvs. într-un proces continuu de formare profesională și educație, precum și necesitatea obținerii de supervizare clinică adecvată.